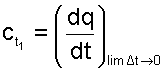
(4.35)
Для реальных газов теплоемкости cV и сP зависят от давления и температуры газа. Это обусловлено наличием сил межмолекулярного взаимодействия, изменением взаимного положения атомов в молекулах (молекулы двух и многоатомных газов не жесткие, присутствует колебательное движение атомов в молекуле) и неравномерным распределением внутренней энергии по степеням свободы в зависимости от изменения температуры и давления газа.
Зависимость теплоемкости газов от давления в большей степени проявляется в состоянии газов, близком к области насыщения, об этом будет сказано в разделе "Реальные газы и пары". Для газов, состояние которых далеко от области насыщения, зависимость теплоемкости от давления незначительна и при практических расчетах ею пренебрегают. Зависимость от температуры очень существенна, ей пренебрегать при точных расчетах нельзя.
Аналитическое выражение этой зависимости весьма сложное и требует нахождения целого ряда экспериментальных констант для каждого газа. Практическое определение теплоемкостей сV и сP реальных газов ведется экспериментально. В соответствии с этим были введены понятия истинной и средней теплоемкости газа.
Истинная теплоемкость газа соответствует расчетному выражению
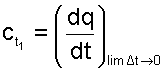 |
(4.35) |
Она определяется как частное от деления элементарной теплоты процесса на элементарное изменение его температуры относительно точки процесса с фиксированной температурой (рис.4.2). Для реальных газов каждому значению температуры процесса соответствует вполне определенное значение истинной теплоемкости.
Экспериментальная зависимость истинной теплоемкости процесса реального газа от температуры обычно представляется в виде степенного полинома графика (рис.4.2), или табличного численного материала.
(4.36) |
Определение теплоты с помощью истинной теплоемкости ведется интегрированием
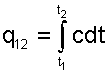 |
(4.37) |
Средняя теплоемкость газа соответствует расчетному выражению
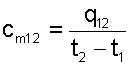 |
(4.38) |
Средней теплоемкостью можно пользоваться только на данном интервале температур. Это очень неудобно, т.к. для практических расчетов необходимо в таблицах экспериментальных данных по средним теплоемкостям предусмотреть все возможные температурные интервалы. Выход из этой ситуации был найден введением средней теплоемкости, определенной от одинаковой начальной температуры. В качестве такой температуры приняли 0 OС. Расчетное выражение средней теплоемкости, определенной от 0 OС, имеет вид
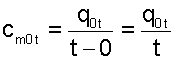 |
(4.39) |
Используя эту теплоемкость, можно определить теплоту и среднюю теплоемкость в любом интервале температур процесса (рис.4.3). Площадь под процессом А1 соответсвует теплоте q01=cm01t1, а под процессом А2 - теплоте q02=cm02t2, теплота процесса 12 определяется как разность этих площадей
(4.40) |
Следовательно, средняя теплоемкость на интервале температур t1 и t2 будет определяться как
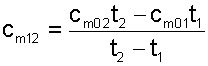 |
(4.41) |
В справочных таблицах свойств газов даются значения истинных теплоемкостей при конкретных температурах и средних теплоемкостей в интервале от 0 OС до t.
Экспериментально проще определяются изобарные теплоемкости газов. Изохорные теплоемкости газов, подчиняющихся уравнению Pv=RT, расчитывают по формуле Майера cV =cP-R. Удельные мольные и объемные теплоемкости реальных газов расчитываются по их соотношениям с удельными массовыми теплоемкостями.
| предыдущий параграф | содержание | следующий параграф |