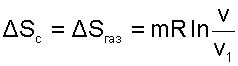
(9.42)
Рассмотрим жесткий сосуд, имеющий объем V и разделенный перегородкой на две части (рис.9.31, слева). Одну часть сосуда с объемом V1 занимает газ при температуре ТОС, равной температуре окружающей среды, в другой части сосуда – абсолютный вакуум. Поскольку газ и окружающая среда имеют одинаковые температуры, такая термодинамическая система находится в равновесном состоянии. Если убрать перегородку (рис.9.31, справа), произойдет расширение газа в вакуум, в результате чего газ займет весь объем сосуда V. Это типичный необратимый процесс, сопровождающийся увеличением энтропии системы и потерей возможной работы (эксергии).
Получим расчетное выражение для изменения энтропии в такой системе при расширении газа в вакуум и убедимся, что энтропия системы возрастет.
Поскольку процесс расширения газа быстротечен, считаем, что теплообмен газа с окружающей средой отсутствует, т.е. Q=0. При расширении газа объем сосуда не изменяется и механической работы он не совершает, т.е. L=0. В соответствии с первым законом термодинамики (Q=U2-U1+L) при Q=0 и L=0 изменения внутренней энергии газа в такой системе нет, т.е. U2=U1. Применительно к идеальному газу нет и изменения температуры в такой системе, Т2=Т1. Таким образом, изменение энтропии системы равно изменению энтропии газа, т.к. теплообмен газа с окружающей средой отсутствует, а изменение энтропии идеального газа может быть рассчитано по изотермическому процессу в виде выражения
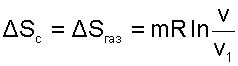 |
(9.42) |
Поскольку при расширении газа его объем увеличивается, то в соответствии с уравнением (9.42) энтропия системы возрастает.
Определить потерю максимально возможной работы (эксергии) при расширении идеального газа в вакуум можно, заменив в нашей системе перегородку поршнем со штоком (рис.9.31, справа) осуществив обратимое изотермическое расширение газа. Таким образом, газ будет совершать такой же изотермический процесс, как и в первом случае, но на штоке поршня будет получена полезная механическая работа. В соответствии с первым законом термодинамики применительно к газу эта работа равна теплоте (L=Q), поскольку изменения внутренней энергии идеального газа в изотермическом процессе расширения нет. Рассчитать эту работу можно по формуле изотермического процесса:
 |
(9.43) |
В соответствии с первым законом термодинамики для всей термодинамической системы эта работа должна быть равна теплоте, полученной газом в обратимом процессе изотермического расширения от окружающей среды, т.е. -QОС=Q=L. Другими словами, полезная работа в нашей системе была получена за счет подвода теплоты к газу от внешней среды. При осуществлении такого расширения газа в вакуум энтропия окружающей среды уменьшится на такую же величину, на какую увеличится энтропия газа:
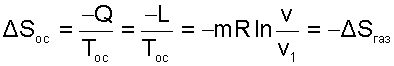 |
(9.44) |
следовательно, в ней протекают только обратимые процессы.
В случае полностью необратимого расширения газа в вакуум вся возможная полезная работа (9.43) теряется. Оценить потерю этой работы, как любого необратимого процесса, позволяет теорема Гюи–Стодолы, выражение которой получается из уравнений (9.42) и (9.43):
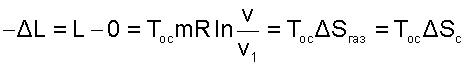 |
| предыдущий параграф | содержание | следующий параграф |