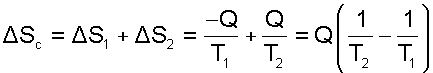
(9.39)
Как было установлено ранее, любая необратимость связана с возрастанием энтропии изолированной системы. Рассмотрим, как различные виды необратимости влияют на возможность получения полезной работы в изолированной системе.
Необратимый теплообмен
Необратимый теплообмен обусловлен наличием разности температур между телами.
Рассмотрим в T,S- диаграмме сначала случай необратимого теплообмена между двумя телами с постоянными температурами Т1 и Т2 (рис. 9.28).
Кроме указанных тел система включает в себя окружающую среду с постоянной температурой ТОС, которая при оценке эксергии используется в качестве охладителя. Как было установлено ранее, энтропия такой системы возрастет на величину
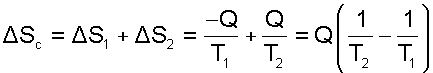 |
(9.39) |
Отличие эксергии первого тела от второго (потеря эксергии) в этом случае будет представлено разницей работ обратимых циклов Карно (Е1=пл.16521 и Е2=пл.34753)
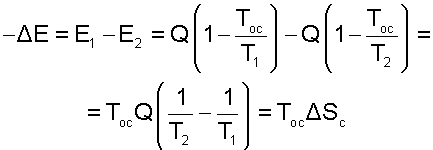 |
(9.40) |
Эта потеря эксергии в T,S- диаграмме представляет площадь
Поскольку энтропия системы в нашем примере увеличивается (ΔSС>0), то в результате необратимости теплообмена эксергия тела с меньшей температурой будет меньше, чем эксергия тела с большей температурой. Следовательно, наличие необратимости теплообмена приводит к снижению работоспособности системы, т.е. к потере возможной работы системы (эксергии).
В случае необратимого теплообмена между телами с переменной температурой (рис. 9.29) будет аналогичный результат.
Здесь доказательств не требуется, так как любой процесс подвода и отвода теплоты в обратимом цикле в T,S- диаграмме можно представить в виде изотермического процесса со среднетермодинамической температурой. На рис.9.29 эксергии тел и уменьшение эксергии вследствие необратимого теплообмена представляют следующие площади:
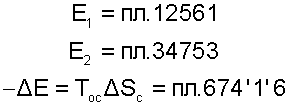 |
Полученное выражение применимо ко всем необратимым процессам. Сформулированное положение, что потеря возможной работы системы (эксергиии) представляет собой произведение абсолютной температуры окружающей среды на увеличение энтропии системы, вызванное необратимостями происхдящих в ней процессов, носит название теоремы Гюи – Стодолы в честь ученых, установивших эту закономерность. Аналитическое выражение этой теоремы имеет вид
(9.41) |
где -ΔE – потеря максимально возможной работы системы - эксергии;
ТОС – абсолютная температура окружающей среды;
ΔSС – возрастание энтропии системы за счет необратимости процессов.
Справедливость теоремы Гюи–Стодолы в дальнейшем будет многократно подтверждена.
| предыдущий параграф | содержание | следующий параграф |