(9.31)
В технической термодинамике наибольший интерес представляет возможность получения работы в системе, состоящей из тел и внешней среды, находящихся в неравновесном состоянии. Окружающая среда в большинстве энергетических установок выступает в качестве холодного источника теплоты: водоемы для ТЭС и АЭС, окружающий воздух для ДВС и ГТУ и т.п.. Тела, не находящиеся в равновесном состоянии с окружающей средой: продукты сгорания органического топлива, тепловыделяющие элементы ядерных реакторов и т.п., представляют собой горячие источники теплоты, т.е. они выступают в роли потенциальных источников работы. Для оценки максимальновозможного количества полезной работы, которое может быть получено в таких системах, в 1955 г. югославским ученым З. Рантом было введено понятие эксергии [5, 6].
Эксергией в объеме называется максимально возможная полезная работа постоянной массы вещества в закрытой системе, которая может быть получена при переходе данного вещества (тела) из неравновесного состояния в состояние равновесия с окружающей средой только по обратимым процессам.
Для иллюстрации понятия эксергии в объеме рассмотрим газообразное тело в цилиндре под поршнем (рис. 9.23). Тело имеет параметры P1, T1, окружающая среда имеет параметры PОС, TОС. Пусть эта система находится в неравновесном состоянии, т.е. P1≠PОС и T1≠TОС. В соответствии с определением эксергии в данной системе получается максимальная полезная работа при обратимом переходе тела из начального состояния в состояние полного термодинамического равновесия с окружающей средой.
Таким образом, эксергия в данном примере будет работой на штоке поршня при обратимом переходе тела из первоначального состояния (I с.) с параметрами Р1, Т1, U1, S.1 в состояние его термодинамического равновесия с окружающей средой (II с.), когда его давление и температура будут такими же как и у окружающей среды РОС, ТОС,, а внутренняя энергия и энтропия тела будут определяться как функция этих параметров UОС=F(РОС,ТОС), SОС=f(РОС,ТОС).
Аналитическое выражение для определения эксергии получается из выражения первого закона термодинамики для тела, находящегося в закрытой системе, при совершении телом обратимых процессов.
Первый закон термодинамики для обратимого процесса имеет вид:
(9.31) |
Количество теплоты, подведенное к телу в нашем примере, можно рассчитать через параметры его состояния, на основании следующих положений:
Поскольку система состоит только из нашего тела и окружающей среды, то количество теплоты, подведенное к телу, равно, взятому с обратным знаком количеству теплоты, отданному окружающей средой Q = -QОС (в соответствии с первым законом термодинамики);
В системе происходят только обратимые процессы, следовательно, в соответствии со вторым законом термодинамики, изменение энтропии такой системы равно нулю ΔSС=ΔSТ+ΔSОС=0, а изменение энтропии тела равно изменению энтропии окружающей среды, взятому с обратным знаком ΔSТ=-ΔSОС;
Температура окружающей среды не изменяется, следовательно, теплоту окружающей среды можно представить в виде выражения, соответствующего изотермическому процессу
(9.32) |
Теплоту, полученную телом, можно рассчитать по выражению (9.30), взяв его с обратным знаком и выразив изменение энтропии окружающей среды через изменение энтропии самого тела
(9.33) |
При изменении объема тело совершает работу L, но всю эту работу как полезную рассматривать нельзя. Часть работы расширения тела L расходуется на перемещение внешней среды, т.е. в нашем примере при движении поршня он перемещает внешнюю среду. Эта работа называется внешней, а так как давление внешней среды не изменяется, то она может быть подсчитана в виде выражения:
(9.34) |
Таким образом, максимальная полезная работа будет представлена в виде разности работы расширения тела и внешней работы:
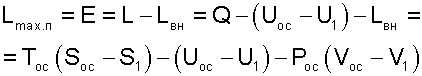 |
(9.35) |
После деления правой и левой частей выражения (9.34) на массу тела получается расчетное выражение удельной максимальнополезной работы, которое и является аналитическим выражением эксергии постоянной массы вещества в закрытой системе:
(9.36) |
В выражении (9.35) параметры начального состояния тела в разностях поставлены на первое место для лучшего восприятия формулы. Из выражения (9.35) видно, что эксергия при неизменном состоянии внешней среды является функцией состояния вещества, т.е. ее можно представить в виде
(9.37) |
Эксергию в объеме можно представить графически в виде площади в термодинамических диаграммах Р,v и Т,s.
На рисунках 9.24 и 9.25 эксэргия идеального газа, имеющего параметры P1, T1, v1, u1, s1, представлена в виде площади 1а2b1.
В данном примере обратимый переход идеального газа из первоначального состояния (точка 1) в состояние равновесия с окружающей средой (точка 2) осуществляется по обратимой адиабате 1а при s1=const и обратимой изотерме а2 при ТОС=const.
В P,v- диаграмме площади под обратимыми процессами 1а и а2 представляют работу изменения объема данного газа. Площадь под адиабатой 1а равна изменению внутренней энергии идеального газа в интервале температур Т1 и ТОС, т.е. пл.1аа'1'1=l1а=u1-uОС. Площадь под изотермой а2 равна теплоте этого процесса, т.е. пл.а22'а'а=lа2=qа2=TОС(sОС-s1). Полная работа изменения объема газа на процессе 1а2 будет представлена в виде алгебраической суммы этих площадей, т.е. l1а2= пл.1аа'1'1+пл.а22'а'а=u1-uОС-TОС(s1-sОС). При графическом суммировании этих площадей в диаграмме Р,v необходимо учитывать отрицательный знак работы на процессе сжатия газа а2 (штриховка этой площади выполнена на рис.9.24 в противоположном направлении по отношению к процессу расширения газа 1а).
Для получения эксергии необходимо из работы изменения объема газа в процессе 1а2 вычесть внешнюю работу e=l1а2-lВН. Расчетное выражение внешней работы газа соответствует величине lВН=PОС(vОС-v1). Внешняя работа, взятая с обратным знаком, в диаграмме Р,v соответствует площади под изобарным процессом 2в, т.е. -lВН=PОС(v1-vОС)=пл.2b1'2'2 (работа процесса 2b положительная). В итоге получили, что эксэргии газа, имеющего параметры точки 1, в Р,v- диаграмме соответствует работа изменения объема процесса 1а2в. Эта работа соответствует площади
В диаграмме Т,s эксергию идеального газа, имеющего параметры точки 1, можно показать в виде площади, перенеся процесс 1а2b из Р,v диаграммы в диаграмму Т,s (рис.9.25).
Площадь под изохорой v1=const процесса с1 соответствует изменению внутренней энергии идеального газа в интервале температур Т1 и ТОС, т.е. пл.11'с'с1=u1-uОС. Площадь под изотермой ТОС=const процесса а2 соответствует его теплоте, т.е. пл.а22'1'а=qа2=TОС(sОС-s1). Площадь фигуры 2bcc'2'2 соответствует работе изменения объема изобарного процесса 2b, т.е. пл.2bcc'2'2=l2d=РОС(v1-vОС).
В результате алгебраического сложения площадей под процессами 1с, а2 и вычтя работу процесса 2b в диаграмме Т,s получили площадь фигуры 1a2b1, которая соответствует величине эксергии, т.е.
Показать эксергию в объеме для газа в виде площади в диаграммах Р,v и Т,s можно, используя и другие обратимые процессы перехода газа из неравновесного состояния в состояние равновесия с окружающей средой.
| предыдущий параграф | содержание | следующий параграф |