Газ и жидкость являются изотропными фазами вещества с одинаковым характером молекулярных взаимодействий и беспорядочным движением микрочастиц.
В отличие от газа и жидкости, твердое кристаллическое вещество является анизотропным. Переход кристаллического вещества в жидкость без видимого фазового перехода не удается получить при любых доступных для воспроизведения давлениях. Для некоторых веществ, изоэнтропных, некристаллических в твердом состоянии: стекла, парафина, гудрона и т.п., - допустим переход из твердой фазы в жидкую и наоборот без видимого скачка свойств. Эти вещества иногда называются твердыми жидкостями. Для них возможно сразу перейти из жидкой фазы в твердую, и наоборот.
Важнейшими термодинамическими характеристиками вещества являются параметры его критического состояния: РКР, TКР, vКР. Они неодинаковы для различных веществ и выражают в обобщенной количественной форме эффект действия сил молекулярного взаимодействия. На критической изотерме, проходящей через точку К, горизонтальный участок имеет нулевую длину, т.е. здесь нет разницы плотностей жидкой и газовой фаз. Превращение жидкости в пар при Р < РКР требует затраты теплоты парообразования. В критической точке при РКР теплота парообразования нулевая, ее нет.
Критическая точка для критической изотермы в Р,v- координатах является точкой перегиба, в этой точке касательная к изотерме представляет собой горизонталь, и, следовательно, для критической точки
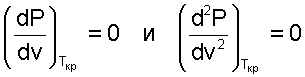 |
Сверхкритические изотермы (Т>ТКР) в Р,v- диаграмме не имеют горизонтальной касательной, для них всегда (dР/dv)Т<0. Для изотерм, близких к критической, характерно наличие перегиба, постепенно исчезающего с повышением температуры.
Для некоторых веществ критические параметры приведены в табл. 5.1.
| Вещество | tКР, 0С | РКР, МПа | Вещество | tКР, 0С | РКР, МПа |
Гелий Водород Азот Кислород
| -268 -240 -147 -118,4
| 0,225 1,25 3,28 4,87
| Углекислота Вода Натрий Ртуть Углерод
| 31 374,12 1837 1490 6027
| 7,38 22,12 35,0 151,0 700,0 |
Из табл. 5.1 видно, почему СО2 выбрана Эндрюсом для опытов. Критические параметры СО2 невелики, поэтому их было просто технически получить в то время.
Проведенные Эндрюсом опыты показали непрерывность свойств газообразной и жидкой фаз реальных веществ и их отличие от идеальных газов. Для анализа этих различий наравне с Р,v- диаграммой широко используется Рv,Р- диаграмма. В этой диаграмме изотермы идеальных газов в соответствии с уравнениями Рv=const и Рv=RT представляют собой горизонтальные прямые.
| предыдущий параграф | содержание | следующий параграф |