(5.36)
При протекании любого газового процесса происходит энергообмен газа с внешней средой и изменение его параметров. Имея изображение политропного процесса в Р,v- и T,s- диаграммах, всегда можно определить знак теплоты, работы и знак изменения параметров этого процесса, т.е. провести качественный анализ процесса. Для иллюстрации этого на рис. 5.11 и 5.12 через произвольную точку А, определяющую начало процесса в Р,v- и T,s- диаграммах, проведены основные термодинамические процессы: изобара, изохора, изотерма, адиабата.
Во всех процессах, начинающихся в точке А и располагающихся: справа от изохоры (n = ±∞) объем увеличивается (dv>0) и, следовательно, работа имеет положительный знак (dl=Pdv>0). В процессах, заканчивающихся слева от изохоры, знаки dv и dl отрицательные;
справа от адиабаты (n=к) энтропия возрастает (ds>0), и теплота имеет положительный знак (dq = Tds>0), т.е. теплота к газу подводится. В процессах, заканчивающихся слевой стороны от адиабаты, знаки ds и dq отрицательные;
выше изотермы (n=1) температура возрастает (dT>0), и увеличивается внутренняя энергия и энтальпия газа (du=cVdT>0, dh= =cPdT>0). В процессах с противоположной стороны от изотермы знаки dT, du и dh отрицательные.
Поскольку площадь под процессом в P,v- диаграмме есть работа изменения объема, а в T,s- диаграмме - теплота, то, имея изображение процесса в этих координатах, можно дать и количественную характеристику процесса.
Например, на рис.5.13 изображен политропный процесс идеального газа 1-2 в Р,v- диаграмме. Площадь под процессом 122'1'1 есть работа изменения объема l. Изменению внутренней энергии процесса 1-2 соответствует работа любого адиабатного процесса в пределах температур от T1 до T2, т.е.
(5.36) |
Проведя адиабату через точку 2 и найдя точку пересечения с ней изотермы T1 =const, получим процесс 2-а, площадь под которым есть изменение внутренней энергии u2-u1. Сумма двух заштрихованных площадей представляет теплоту процесса
(5.37) |
Выражение первого закона термодинамики с использованием энтальпии
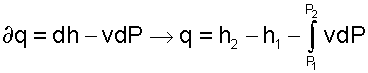 |
(5.38) |
позволяет графически представить его составляющие в Р,v- координатах.
Величине - 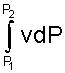 в Р,v- диаграмме соответствует площадь под процессом 1-2 в проекции на ось давлений 122'1'1.
в Р,v- диаграмме соответствует площадь под процессом 1-2 в проекции на ось давлений 122'1'1.
Рис. 5.13. Изображение q, l, изменения u и h политропного процесса идеального газа в P,v- диаграмме . . . . . . ............ |
Разницу энтальпий можно представить в виде площади под адиабатным процессом 2-а (dq = 0) в проекции на ось Р в интервале температур T1 и T2
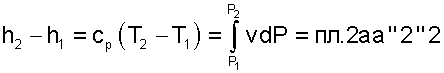 |
(5.39) |
Сумма этих площадей есть теплота процесса q = пл.12aa'1'1.
В T,s- диаграмме площадь под процессом 1-2 (рис. 5.14) представляет теплоту этого процесса q=пл.122'1'1. Эту площадь, согласно первого закона термодинамики, можно представить в виде двух частей:
изменения внутренней энергии, в виде площади под любой изохорой в интервале температур Т1 и Т2:
(5.40) |
(5.41) |
Рис. 5.14. Изображение q, l, изменения u и h политропного процесса идеального газа в T,s- диаграмме . . . . . . ............ |
Изменение энтальпии в процессе 1-2 можно представить в виде площади под любой изобарой в интервале температур Т1 и Т2:
(5.42) |
Таким образом, имея изображение политропного процесса газа в Р,v- или T,s- диаграмме, можно оценить величину и знак теплоты, работы изменения объема, изменение внутренней энергии, энтальпии и других термодинамических параметров состояния.
| предыдущий параграф | содержание | следующий параграф |